肾细胞癌(以下简称肾癌)是泌尿系常见的恶性肿瘤,占成人恶性肿瘤的 2%~3%,发病率呈逐年上升趋势。发病的危险因素包括吸烟,肥胖和高血压。因此,对于预防肾细胞癌最主要的方式是戒烟及减重(强烈推荐)。
2017 年 3 月,欧洲泌尿外科学会(EAU)发布了肾细胞癌指南,2017 版 EAU 指南部分章节对推荐程度采用了新的 GRADE 分级方式,使用强或弱代替原有的字母表达。箭头表示推荐等级较前一版的变化,↑↑、↑、↓、↓↓分别代表推荐等级较前明显增强、增强、减弱、明显减弱。
在 2016 年 WHO 分型中肾细胞癌包含了一系列的组织病理学分型。主要有三种类型的肾细胞癌:透明细胞癌(ccRCC),乳头状细胞癌(1 型和 2 型),嫌色细胞癌(chRCC),其他类型包括集合管癌和不常见肾肿瘤如与终末期肾病相关肾癌、获得性囊性相关肾癌、乳头状腺癌、遗传性肾癌、血管平滑肌脂肪瘤等。
其他类型肾肿瘤治疗的证据总结和推荐:
诊断评估
1. 症状:大多数肾细胞癌,直到晚期时才有症状。超过 50% 的肾细胞癌是偶然发现的。典型的肾癌三联征腰痛、肉眼血尿和可触及的腹部包块很少见。在 30% 的症状性肾细胞癌中发现存在副瘤综合征。
2. 体格检查:价值有限。
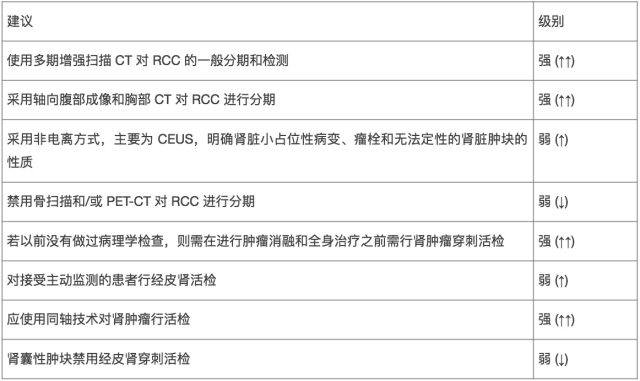
3. 影像学检查:大多数肾肿物是通过腹部超声或 CT 扫描检查出来的。胸部 CT 可以准确地评估胸部的分期。专家一致认为大多数肾细胞癌骨转移时是有症状的,因此通常不建议进行骨扫描。肾脏囊性肿物的评估推荐基于 CT 影像的 Bosniak 分型,预测囊性肾肿瘤的良恶性。
4. 肾肿瘤活检:经皮肾肿瘤的活检通常用于放射线检查无法确诊的肾肿物。通常被用作以下情况:肾脏小肿物的主动监测、消融治疗前获得组织病理学诊断、在转移性肾癌的患者中选择合适的内科和外科治疗方案。
肾细胞癌(RCC)诊断评估的证据总结和建议
证据总结 | 证据等级 |
多期增强扫描 CT 在 RCC 肿瘤浸润、瘤栓形成及转移性 RCC 诊断、描述方面具有较高的灵敏度和特异性 | 2 |
与 CT 相比,MRI 诊断肾脏小占位性病变和瘤栓的敏感性和特异性略高 | 2 |
超声造影(CEUS)在明确肾占位性病变性质方面具有较高的灵敏度和特异度 | 2 |
超声、多普勒超声和 PET-CT 诊断 RCC 的灵敏度和特异性均较低 | 2 |
治疗
1. 局限性肾细胞癌(T1-2N0M0)的治疗
(1)外科治疗
肾部分切除术与根治性肾切除术相比,肿瘤特异性生存期相似,且更好保留肾单位,因此降低日后代谢综合征和心血管疾病的发生率。但是肾部分切除术与根治性肾切除术在总生存率上孰优孰劣仍然无法确定。
肾上腺切除术:一项前瞻性研究比较根治性肾切除术(RN)和肾部分切除术(PN)行同侧肾上腺切除术,多因素分析显示肿瘤位于上极不能预测肾上腺是否受侵,但是肿瘤的大小可以。肾上腺切除术 5 年或 10 年的总生存时间(OS)无差异。肾上腺切除与否主要取决于影像学及术中所见。
临床分期 N0 淋巴结清扫术:PN 或 RN 行淋巴结清扫术的指证仍然有争议。不到 20% 的可疑转移淋巴结是阳性的。
栓塞术:常规肾切除术前,肿瘤栓塞没有获益。
推荐 | 分级 |
局限性肾癌手术治疗可以治愈 | 强 (↑↑) |
T1 期肿瘤提供肾部分切除术 | 强 (↑↑) |
临床无肾上腺受侵证据时不进行同侧肾上腺切除术 | 强 (↓↓) |
临床特点不佳的患者包括原发肿瘤较大或组织学有肉瘤 | 弱 (↑) |
(2)RN 或 PN 技术
RN 技术:尚没有随机对照治疗试验比较腹腔镜和开放根治性肾切除术。目前研究发现腹腔镜和开放根治性肾切除术可以获得相似的肿瘤学结果。可以采用经腹腔途径或经腹膜后途径。
PN 技术:在有腹腔镜经验的中心,腹腔镜与开放 PN 在无进展生存期(PFS)和 OS 上无差异。切缘阳性约占 PN 的 8%,切缘阳性患者长期的肿瘤学结果仍然未知,但是切缘阳性不一定会有肿瘤特异性率生存降低,因此,进一步行 RN 或二次切除切缘在多数病例是过度治疗。切缘阳性患者应该被告知密切影像学监测和局部二次治疗的风险增加。
推荐 | 分级 |
T2 期肾肿瘤应行腹腔镜根治性肾切除术,不应行肾部分切除术 | 强 (↑↑) |
T1 期肾肿瘤应行肾部分切除术,不进行根治性肾切除术 | 强 (↓↓) |
(3)其他可选择的治疗方案
主动监测:短期和中期的肿瘤学结果表明,主动监测适合于某些高龄或合并症多的、最初发现肿瘤较小,随访过程肿瘤进展可以治疗的患者。
冷冻消融:主要通过经皮穿刺或腹腔镜途径。到目前为止没有研究表明冷冻消融术的肿瘤学结果优于 PN。
射频消融:近期 meta 分析射频消融(RFA)和 PN 比较并发症和术后 eGFR,在 RFA 组局部肿瘤复发率高于 PN 组,但是远处转移两组没有差异。
其他消融技术如微波消融、激光消融和高能聚焦消融等,这些技术仍处在实验阶段。
推荐 | 级别 |
老年患者和/或合并疾病多的肾脏小肿瘤患者给予主动监测、射频消融或冷冻消融术 | 弱 (↑) |
2. 局部进展性肾细胞癌的治疗
(1)临床淋巴结阳性的治疗
出现临床淋巴结阳性的患者,淋巴结清扫术是合理的。但是扩大淋巴结清扫术仍然存在争议。
(2)局部进展无法切除的 RCC 的治疗
对于无法切除的局部进展性肿瘤,栓塞术可以控制症状,包括肉眼血尿或腰痛。新辅助靶向治疗减小肿瘤体积仍然处在实验阶段,不能被推荐应用到临床实践。
(3)肾癌伴有静脉癌栓的治疗
证据总结 | LE |
局部进展期肾癌伴有临床肿大淋巴结,淋巴结清扫的生存获益仍然不清,但是淋巴结清扫能帮助分期 | 3 |
少量数据表明,在非转移性肾癌中,肿瘤瘤栓切除术可以获益 | 3 |
肿瘤栓塞或下腔静脉滤器没有帮助 | 3 |
推荐 | 分级 |
伴有临床肿大淋巴结的患者,淋巴结清扫术可以帮助分期或局部控制 | 弱 (↑) |
非转移性 RCC 患者,应切除肾肿瘤及腔静脉癌栓 | 强 (↑↑) |
(4)辅助治疗
研究表明 IFN-α和 IL-2 治疗没有显示生存获益。到目前为止,没有证据表明使用 VEGF-R 或 mTOR 抑制剂用于辅助治疗。2015 年舒尼替尼、索拉非尼和安慰剂对照的最大辅助治疗试验结果表明,试验组与安慰剂组在无病生存和 OS 上无差异,因此,舒尼替尼或索拉非尼不推荐用于辅助治疗。
证据总结 | LE |
根治性肾切除术后辅助细胞因子治疗不改善生存期 | 1b |
高危患者行根治性肾切除术后,舒尼替尼在 2 篇研究中 1 篇改善无疾病生存期,而不改善总生存期 | 1b |
推荐 | 分级 |
不能提供索拉非尼用于辅助治疗 | 强 (↓↓) |
高危肾透明细胞癌外科手术后不提供舒尼替尼用于辅助治疗 | 弱 (↓) |
3. 进展性/转移性肾细胞癌
(1)原发灶的局部治疗
减瘤性肾切除术:对于多数转移性患者,减瘤性肾切除术是姑息治疗,通常需要全身治疗。减瘤性肾切除术推荐用于体能评分好,原发灶较大,转移灶少的转移性肾细胞癌患者。
原发肿瘤栓塞术:不适合手术或不能手术切除的患者,栓塞术可以控制症状,包括肉眼血尿或腰痛。
证据总结 | LE |
减瘤性肾切除术联合干扰素-α改善转移性肾细胞癌体能评分高患者的生存期 | 1a |
减瘤性肾切除术联合单发转移灶或寡转移灶切除术可以改善总生存期和推迟全身治疗 | 3 |
推荐 | 级别 |
提供轻危至中危转移性肾细胞癌患者减瘤性肾切除术 | 弱 (↑) |
(2)转移灶的局部治疗
推荐 | 级别 |
在低危转移灶可完全切除或需要控制局部症状的患者,考虑行转移灶的局部治疗 (包括转移灶切除术) | 弱 (↑) |
立体定向放疗用于临床骨转移或脑转移的局部控制或缓解症状 | 弱 (↑) |
4. 进展性/转移性肾细胞癌全身治疗
(1)化疗
证据总结 | LE |
转移性肾细胞癌 5-FU 联合免疫治疗与干扰素-α等效 | 1b |
对于转移性 RCC 的治疗,除了吉西他滨和多柔比星对肉瘤样变和快速进展性病变有效之外,其他化疗方法均无效 | 3 |
推荐 | 级别 |
化疗禁用于转移性肾透明细胞癌的一线治疗 | 强 (↓↓) |
针对肉瘤样变或快速进展性 RCC 患者,可联合应用吉西他滨和多柔比星治疗 | 弱 (↑) |
(2)免疫治疗
推荐 | 级别 |
一线或二线 VEGF 靶向药治疗转移性肾癌后推荐应用纳武单抗 | 强 (↑↑) |
不推荐干扰素-α或高剂量白介素-2 作为转移性肾癌的一线治疗 | 弱 (↓) |
(3)靶向治疗
酪氨酸激酶抑制剂:索拉非尼、舒尼替尼、帕唑帕尼、阿昔替尼、卡博替尼、乐伐替尼
单克隆抗体:贝伐单抗
mTOR 抑制剂:替西罗莫司、依维莫司
转移性肾细胞癌全身治疗的证据和建议 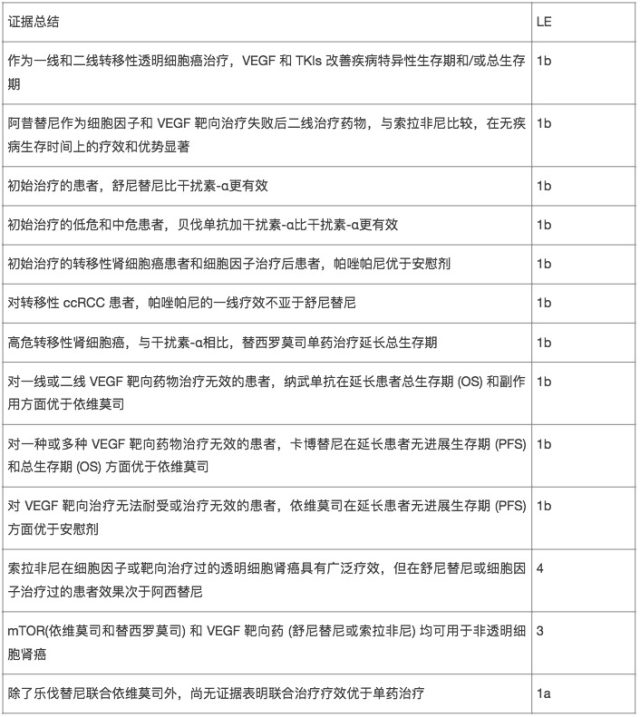
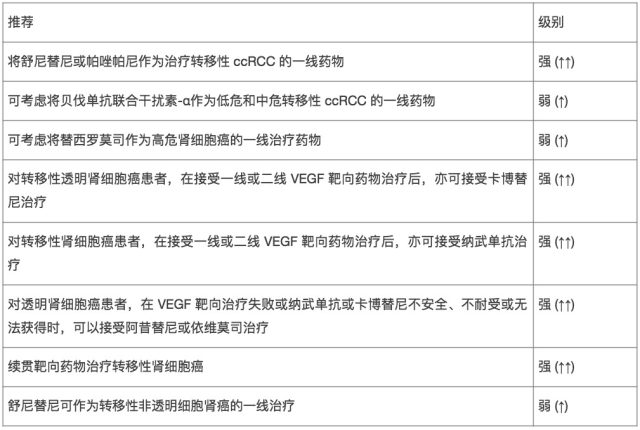
5. 复发性肾细胞癌
证据总结 | LE |
局部肾窝的孤立复发罕见 | 3 |
无肉瘤样成分的局部复发灶切除可以获得局部长期控制和改善生存期 | 3 |
推荐 | 级别 |
如果可行,给予局部复发灶的手术切除 | 弱 (↑) |
随访
证据总结 | LE |
外科手术治愈后患者监测局部复发及远处转移 | 4 |
肿瘤较大(>7 cm)或切缘阳性,行保肾手术后复发风险较高 | 3 |
进行随访的患者比不随访的患者具有更好的生存期 | 3 |

