肾移植是终末期肾病(ESRD)患者的重要治疗手段,围手术期的规范管理是成功实施移植的重要保障。备受泌尿外科医师关注的 EAU 指南已陆续更新。较以往版本不同的是,2018 版指南将推荐强度简化成「强」与「弱」,以方便临床应用。下面为各位带来最新的 EAU 肾移植指南编译。
活体供体取肾手术

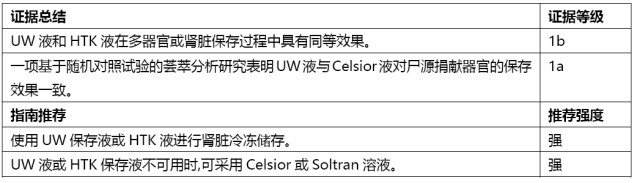
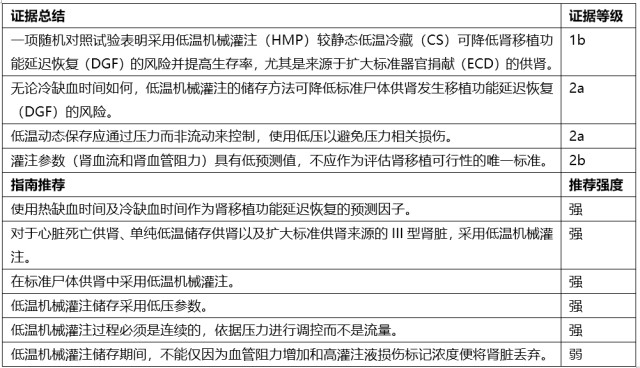
供肾的储存
肾脏穿刺

围术期药物及液体管理
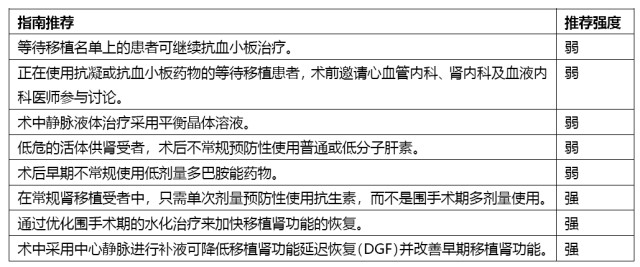
证据总结 | 证据等级 |
术前血液透析可能导致移植手术推迟、增加冷缺血时间并增加 DGF 的风险。 | 2 |
指南推荐 | 推荐强度 |
移植手术前进行透析或者保守治疗以纠正患者水及电解质紊乱,同时考虑移植功能稳定的可能性。 | 弱 |
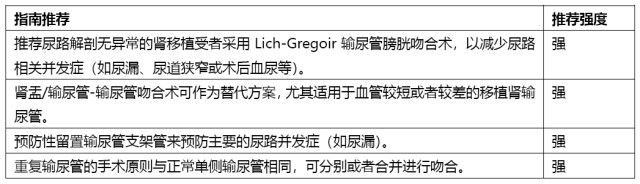
手术相关技巧

肾静脉过短多见于右侧。对于供肾静脉过短的情况,进行静脉吻合时可尝试髂动脉、髂静脉换位。必要时进行右肾静脉延长,尸体供肾可利用下腔静脉,活体供肾可考虑利用供者的生殖静脉或受者的大隐静脉。

手术并发症
手术并发症包括:(1)血管并发症:出血、动静脉血栓形成、移植肾动脉狭窄、肾活检后动静脉瘘和假性动脉瘤形成;(2)泌尿系并发症:尿瘘、尿道狭窄、血尿、膀胱输尿管反流及急性肾盂肾炎、肾结石;(3)其他:切口感染、切口疝、淋巴囊肿等。
动脉血栓形成
发生率在 0.5%~3.5%,与术者吻合技巧、血管状态、排斥反应等多个因素有关。临床表现急性尿量减少及肾功能指标升高并造成移植肾丢失。通过超声检查可诊断并推荐行手术探查。

肾静脉血栓形成
是移植肾早期并发症之一(发生率 0.5%-4%),也是术后第一个月移植肾丢失的最重要原因之一。病因包括吻合技巧不足、手术困难以及受体高凝状态。超声可表现为静脉血流缺如及动脉异常血流,移植肾体积增大。推荐进行手术探查,但该并发症仍可导致较高的移植肾丢失率。

移植肾动脉狭窄
发生率在 1%~25% 之间,与动脉管腔狭窄、动脉粥样硬化、动脉瓣缺如、手术损伤等有关。高血压药物控制不佳、不伴随肾积水或尿路感染的血肌酐水平升高时应可疑该并发症。超声下收缩峰值速率(PSV)> 200 cm/s 可确诊。具有临床症状伴/不伴随血管狭窄>50% 应积极治疗。
指南推荐 | 推荐强度 |
推荐行彩色多普勒超声检查,无法确诊时可进一步行 MRI 或 CTA。 | 强 |
经皮腔内血管成形术/支架置入术为动脉狭窄的一线治疗方案。 | 强 |
近期移植手术、血管多发且较长狭窄或介入治疗失败时,考虑手术治疗。 | 强 |
肾穿刺活检可造成动静脉瘘和假性动脉瘤形成。动静脉瘘大多数病例通常无症状,可在术后 1-2 年内自行消退。约 30% 的病例病情进展时可出现血尿、高血压等症状,严重者可致移植肾丢失。假性动脉瘤如不处理可因瘤体不断增大而破裂出血。
指南推荐 | 推荐强度 |
怀疑动静脉瘘和假性动脉瘤形成,推荐行彩色多普勒超声检查。 | 强 |
伴有症状的动静脉瘘或假性动脉瘤病例,推荐血管造影栓塞术为一线治疗方案。 | 强 |
淋巴囊肿
发生率为 1%~26%,研究表明其发病不仅与手术因素有关,还与糖尿病、M-TOR 抑制剂治疗(如西罗莫司)以及急性排斥反应等密切相关。
指南推荐 | 推荐强度 |
对于较大以及伴随症状的淋巴囊肿,推荐行经皮穿刺引流。 | 强 |
穿刺引流失败可尝试手术开窗引流术。 | 强 |
尿瘘
发生率为 0%-9.3%,通常因输尿管狭窄或输尿管吻合失败所致,也与受者年龄、肾动脉数量、血管吻合部位以及急性排斥反应等有关。术中保证远端输尿管的血供并常规留置双 J 管,可降低输尿管狭窄的发生率。
指南推荐 | 推荐强度 |
发生尿瘘可选择方案包括:留置双 J 管、膀胱导尿管或经皮肾造瘘管。 | 强 |
尿瘘保守治疗失败时,可考虑手术治疗。 | 强 |
输尿管狭窄发生率在 0.6%-10.5%。早期狭窄(术后 3 个月内)与手术技巧及术中输尿管营养血管的损伤有关,远期狭窄(手术 6 个月后)可由感染、纤维化、血管疾病及排斥反应所致。临床表现多为持续性肾积水以及肾功能损害。
指南推荐 | 推荐强度 |
输尿管狭窄病例留置肾造瘘管,可进行肾脏减压治疗并顺行肾盂造影明确诊断。 | 强 |
输尿管狭窄<3 cm,可选择重建手术或内镜治疗(经皮球囊扩张或顺行输尿管软镜钬激光狭窄切开)。 | 强 |
远期狭窄复发和/或狭窄> 3 cm,选择合适的受者进行手术重建。 | 强 |
移植术后 尿路结石发生率为 0.2%-1.7%,发病原因与肾脏超滤、肾小管酸中毒、复发尿路感染、低枸橼酸尿症、高尿酸血症、甲状旁腺功能亢进以及尿道狭窄等多个因素有关。此外,泌尿系统吻合术也是危险因素之一。移植肾结石的诊治策略与常规结石治疗相似。对于较大结石合并输尿管梗阻,可考虑输尿管-输尿管吻合、肾盂输尿管吻合及输尿管膀胱再植术。

供者-受者配型
人类白细胞抗原(HLA)匹配与移植肾结局密切相关。HLA 不相容可导致受者 B 细胞与 T 细胞免疫反应,从而诱导移植排斥反应的发生。为了避免超急性排斥反应(HAR),移植前应进行充分的交叉配型试验。既往 ABO 血型抗原与 HLA 抗原相容性对肾移植至关重要。随着抗体消除方法、有效的免疫抑制以及新型药物(如抗 B 细胞药物)的引入,ABO 血型不相容的活体肾移植获得良好远期结局已成为可能,虽然这也面临着更高的医疗费用以及感染风险。

肾移植后的免疫抑制治疗
肾移植术后免疫抑制治疗的基本原则是「生存平衡」,既需要足够剂量的药物抑制排斥反应,又要尽可能不损害患者的健康。同过免疫抑制剂的联合运用可降低药物的使用剂量,减少不良反应的发生。免疫抑制治疗的初始方案包括:
1. 钙调磷酸酶抑制剂 (CNI): 首选他克莫司或环孢素;
2. 霉酚酸类(MPA)药物:吗替麦考酚酯(MMF)或麦考酚钠肠溶片(EC-MPS);
3. 激素:泼尼松龙或甲泼尼龙;
4. 诱导治疗:低危及标准风险患者首选巴利昔单抗,高危患者选择抗胸腺细胞球蛋白(ATG)。
钙调磷酸酶抑制剂(CNI)
指南推荐 | 推荐强度 |
推荐使用钙调磷酸酶抑制剂(CNI)预防排斥反应,目前仍为免疫抑制联合治疗方案的基石。 | 强 |
使用他克莫司作为 CNI 治疗的一线用药。 | 强 |
根据环孢素和他克莫司的血药浓度来调整 CNI 的治疗剂量。 | 强 |
霉酚酸类药物(MPA)

硫唑嘌呤
指南推荐 | 推荐强度 |
硫唑嘌呤作为免疫抑制药物可用于低风险人群,特别是对于不能耐受 MPA 类药物患者。 | 弱 |
糖皮质激素
指南推荐 | 推荐强度 |
推荐糖皮质激素作为围术期以及移植术后早期免疫抑制治疗的重要部分。 | 强 |
移植术后维持治疗阶段使用 CNI 联合 MPA 治疗的标准免疫风险患者,可考虑撤除糖皮质激素。 | 弱 |
哺乳动物雷帕霉素靶蛋白抑制剂(m-TORi)
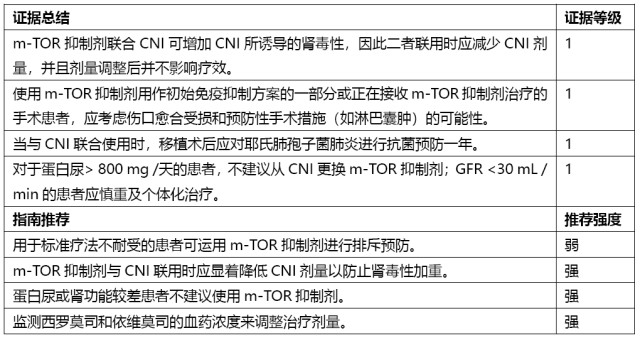
免疫诱导治疗
指南推荐 | 推荐强度 |
对于正常免疫风险的患者,使用白细胞介素-2 受体抗体进行免疫抑制诱导治疗,以降低急性排斥反应的发生率。 | 弱 |
对于高危免疫患者,建议使用 T 细胞清除抗体进行诱导治疗。 | 弱 |
免疫并发症:
免疫排斥反应可根据其发病机制主要分为 T 细胞介导排斥反应(TCMR)和抗体介导排斥反应(ABMR)。慢性 ABMR 被认为是远期移植肾丢失的主要原因。排斥诊断主要依靠肾穿刺活检并依据 Banff 标准分期,以评估其预后及制定治疗策略。

超急性排斥反应(HAR)
指南推荐 | 推荐强度 |
为预防 HAR,移植前应对供者和受者进行充分的 ABO 血型与 HLA 配型试验。 | 强 |
T 细胞介导的急性排斥反应
指南推荐 | 推荐强度 |
除了确保足够的免疫抑制治疗外,使用激素冲击疗法作为 T 细胞介导排斥反应的一线治疗。 | 强 |
严重或激素抵抗的排斥反应,使用强化免疫抑制/高剂量的激素治疗甚至是 T 细胞清除制剂。 | 强 |
抗体介导的排斥反应
指南推荐 | 推荐强度 |
抗体介导的排斥治疗应该包括抗体消除。 | 强 |
移植后随访

